[편집자주] 지난해 서울의 임상시험 도시 점유율은 세계 1위, 국내 전체로 따졌을 때 한국은 세계 6위에 이름을 올리고 있다. 정부는 오는 2022년까지 임상시험 5대 강국에 진입하겠다며 관련 규제는 완화하고 지원은 늘려 왔다. 그 결과, 대한민국은 다국적 제약사의 ‘임상시험’ 놀이터가 됐다. 임상시험의 위험성, 그리고 임상시험 산업육성이라는 포장지에 감춰진 정부와 다국적 제약사의 실태를 추적한다.
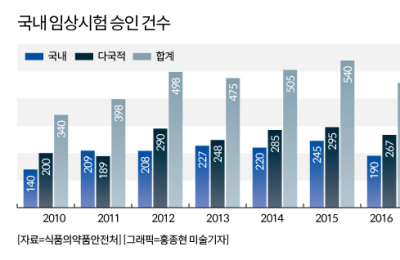
[서울=뉴스핌] 임성봉 기자 = 2000년대 이후 현재까지 국내 임상시험 건수가 폭발적으로 증가하는 가운데 전문가들은 세계임상 선진국의 안전시스템을 벤치마킹해야 한다고 조언한다. 국민의 안전과 관련된 문제인 만큼 임상시험 건수를 늘리는 정책보다 촘촘한 안전규제를 따라야 한다는 설명이다.
◆“한국, 미국식 모델 차용했지만 국내 여건 맞게 변형해야”
국내 임상시험 실시기관이 의무적으로 도입·운영하고 있는 임상시험심사위원회(IRB)는 미국식 모델이다. 병원 등이 자체적으로 IRB를 꾸리고 병원의 이해관계가 없는 위원을 위촉해야 하는 조항 등도 유사하다.
국내에서 IRB 도입이 의무화된 건 지난 2005년이다. 당시 보건복지부는 일명 ‘황우석 사태’ 이후 ‘생명윤리 및 안전에 관한 법률’을 공포, 인간을 대상으로 하는 모든 임상시험은 IRB의 심의를 거치도록 의무화했다. 이후 식약처는 2014년 IRB 운영 가이드라인을 마련해 현재까지 운용하고 있다.
미국은 이미 50여년 전인 1966년 “피험자의 권리와 복지가 충분히 보호되고 있는지 독립적인 사전 판단을 받아야 한다”는 IRB의 근간이 되는 규정을 마련했다. 이는 당시 미국 국립보건원이 국가보건자문위원회에 피험자 보호를 위한 제도 마련을 건의한 데 따른 조치였다.
 |
| 미국 국립보건원의 역할을 소개한 글 [캡처=미국 국립보건원 홈페이지] |
이후 미국은 1974년 이 규정을 토대로 ‘국가연구에 관한 법률’을 제정해 피험자 보호 사항을 법제화 했다. 이에 따라 모든 임상시험 실시기관에 IRB가 설치됐고 의회는 ‘피험자 보호 국가위원회’를 신설해 임상시험을 관리·감독했다.
또 2000년에는 국립보건원 산하에 있던 연구위험예방과를 보건부 산하로 격상시키는 한편 연방정부마다 피험자보호국이 설치됐다. 이는 임상시험 참여자가 실시기관은 물론 중앙정부와 연방정부 차원에서도 보호받을 수 있도록 2중, 3중의 장치를 마련한 것으로 평가된다.
이처럼 한국은 미국을 모델로 IRB 제도를 도입했지만, 국가나 지자체 차원의 관리·감독 제도는 부분적으로만 도입했다는 차이가 있다. 더욱이 전문가들은 국내 의료계는 미국과 달리 업계가 좁아 미국의 IRB 제도를 그대로 따르기에는 무리가 있다고 지적한다.
 |
| 미국 국립환경보건과학연구소가 IRB의 역할과 기능 등에 대해 소개한 내용 [캡처=미국 국립환경보건과학연구소 홈페이지] |
김남희 참여연대 조세복지팀장은 “미국은 한국에 비해 임상시험의 역사도 길고 업계도 커서 병원과 이해관계가 없는 전문가들이 많지만 학연, 지연, 혈연으로 묶인 한국은 상황이 전혀 다르다”며 “결국 정부나 지자체 차원에서 막강한 권한을 가진 독립적인 기구를 꾸려 임상시험 참여자 보호에 나서야 한다”고 조언했다.
◆비영리단체 통한 IRB 운영하는 대만
대만은 지역마다 IRB를 설치하는 것은 물론 CDE(Center for drug evaluation), JIRB(Joint institutional review board)라는 비영리 기관을 통해 임상시험을 심사하고 있다.
CDE는 비영리, 비정부 기관으로 임상시험과 신약 허가를 검토한다. 비영리 기관이지만 5개 부서, 70여 명을 운용하는 조직이다. 특히 외부 인사들로 구성된 자문위원회를 구성, 임상시험 심사에 대한 객관성과 독립성을 확보했다.
임상시험 참여자를 보호하기 위해 1997년 만들어진 JIRB는 각 지역의 IRB 연합체다. JIRB의 임원은 지역 IRB의 추천에 의해 구성된다. 또 임상시험의 윤리성을 검토하기 위해 의학 전문가 외에 법률가, 사회학자, 성직자, 통계학자 등이 JIRB 위원에 포함된다. 지역 IRB의 추천을 받은 과학자 50여 명이 임상시험을 심사한다.
이처럼 대만은 각 기관의 IRB, 이들이 모인 지역 IRB, 지역 IRB가 모인 연합 JIRB 등 임상시험 심사를 위한 다층적 장치를 설치했다. 이 중 가장 중추적인 역할은 지역 IRB가 맡는다. 우리나라에도 대만의 지역 IRB와 같이 다기관 IRB가 존재하지만, 지난 2014년에서야 대구 지역에서 처음 출범하는 등 아직 걸음마 단계다.
 |
| 한국임상시험산업본부가 제작한 '안전한 임상시험을 위한 보호프로그램' 영상 화면 [사진=한국임상시험산업본부] |
◆“임상 산업 육성, 경제성보다 국민의 안전이 우선”
시민단체와 전문가들은 국내 상황에서 임상시험 참여자를 보호하기 위해서는 정부와 지자체 차원의 독립기구가 필요하다고 입을 모은다. 미국의 IRB 제도를 골격으로 하되 막강한 권한을 가진 정부나 지자체가 적극적으로 개입해야 한다는 이야기다.
김명희 국가생명윤리정책원 사무총장은 “공공의료가 발달한 한국이 미국의 IRB가 아닌 국가의료시스템(NHS)을 운영하는 영국의 모델을 참고했다면 더 좋았을 것”이라며 “영국의 경우, 임상시험 진행과 부작용, 그리고 피해자 구제까지 국가가 관리하기 때문에 이 중 국내에 적용할 수 있는 부분이 있는지 검토가 필요하다”고 말했다.
김재천 건강세상네트워크 운영위원은 “현재로서는 정부가 중앙 IRB를 구성, 운영하고 모든 임상시험을 이 중앙 IRB가 1차적으로 심사해 위험성을 최소화해야 한다”며 “식약처가 운영하는 HRPP(임상시험 참여자 보호프로그램)도 의무적으로 운영하도록 강제해야 한다”고 강조했다.
imbong@newspim
 영상
영상