[뉴스핌=한태희 기자] 앞으로 메르스(중동호흡기증후군)를 포함한 신종감염병 치료제가 동물한테 효과가 있으면 바로 허가를 내준다.
또 임상 2상 시험 자료만 가지고 허가를 결정하는 '조건부 허가제'를 항암제 및 희귀의약품에서 알츠하이머나 뇌경색 치료제까지 확대 적용한다.
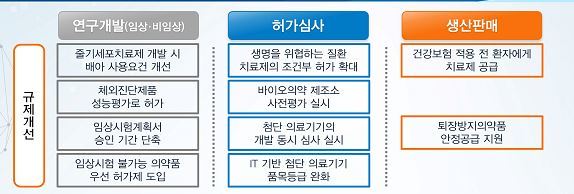
식품의약품안전처는 18일 대통령 주재로 열린 제5차 규제개혁장관회의에서 이 같은 내용을 담은 '바이오헬스케어 규제혁신' 방안을 발표했다. 의약품 시장 진입 문턱을 낮춰주고 연구개발 때 걸림돌로 작용하는 규제를 푼다는 게 주 내용이다.
우선 신종감염병 치료제가 신속하게 공급될 수 있도록 허가 문턱을 낮춘다. 동물 시험에서 유효성이 확인되면 허가한다는 것. 현재 모든 의약품은 동물 시험에서 효능을 확인했어도 사람에게 적용하는 임상 시험을 해야 한다. 하지만 신종감염병 치료제는 윤리적인 문제로 개발 단계에서 임상 시험이 어려웠다.
식약처 관계자는 "동물성시험자료를 통해서 유효성을 평가하고 사용 단계에서 유효성을 추가 확인할 것"이라고 설명했다.
임상 2상 결과만 가지고 허가하는 '조건부 허가제'도 확대한다. 이에 따라 알츠하이머나 뇌경색 등 생명을 위협하는 질환에 사용하는 치료제는 임상 2상 후 시판할 수 있는 길이 열린다. 현재는 항암제나 희귀 의약품에만 조건부 허가제를 적용했다.
식약처 관계자는 "시장 진입을 2~3년 단축하는 효과가 있다"며 "향후 감염병 등에 사용하는 바이오 신약까지 확대할 계획"이라고 말했다.
허가 받은 신약은 건강보험 적용 전에 환자에게 무상 또는 저가로 공급될 수 있는 법적 근거도 준비한다. 신약 투약에 따른 환자 부담을 줄여준다는 것.
아울러 바이오의약품 허가 전에 실태조사를 해서 시장 진입 기간을 줄여준다. 의료기기 또한 허가 신청 즉시 허가가 날 수 있도록 단계별 심사제도를 도입한다.
이외 줄기세포치료제를 개발할 때 배아 사용 규제를 풀어준다. 몇가지 안정성 시험만 통과하면 바로 사용할 수 있게 한다는 것. 현재는 배아 기증자의 병력 정보가 확인돼야만 사용할 수 있다. 체외 진단용 의료기는 임상시험기관 외에서 한 성능시험 자료만으로도 허가를 내준다.
식약처 관게자는 "바이오헬스케어 산업은 전 세계가 주목하는 미래 성장 동력으로 국내에서도 차세대 산업으로 성장하고 있다"며 "이번 규제혁신이 원활하고 실효성 있게 추진될 수 있도록 적극 지원하겠다"고 말했다.
[뉴스핌 Newspim] 한태희 기자 (ace@newspim.com)
 영상
영상