[뉴스핌=박미리 기자] 국내 제약·바이오사들이 임상 제품들의 상용화에 본격 나설 전망이다. 연말까지 상당수 회사들이 임상을 통과한 제품에 대해 국내외에서 판매 허가를 받을 것으로 보이기 때문이다.
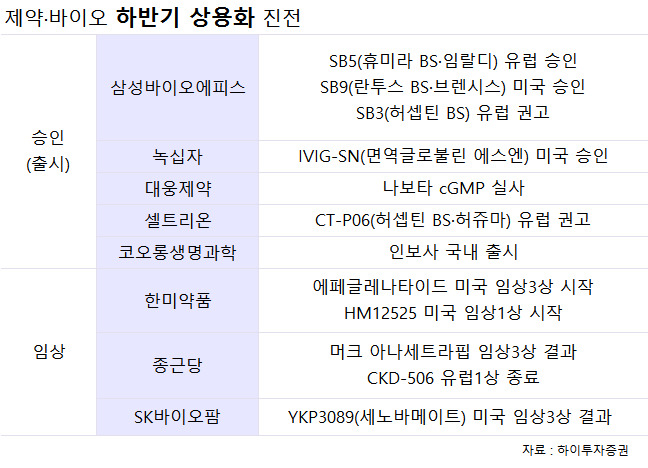
3일 관련업계에 따르면 삼성바이오에피스는 올 하반기 유럽에서 류머티스성 관절염 치료제인 '휴미라' 바이오시밀러 'SB5'의 판매 승인을 받을 것으로 관측된다.
올해 미국에서 류머티스성 관절염 치료제인 '레미케이드' 바이오시밀러 'SB2', 당뇨병 치료제인 '란투스' 바이오시밀러 'SB9'가 판매 허가를 받은 데 이어서다. 이중 'SB2'는 지난달부터 시판을 시작했다.
아울러 삼성바이오에피스는 올 하반기 유럽에서 유방암 치료제인 '허셉틴' 바이오시밀러 'SB3'에 대한 권고도 받을 것으로 보인다. 권고는 승인 전 전문가로 구성된 자문위원회가 허가 여부에 대해 의견을 내리는 것이다. 따라서 지난해 삼성바이오에피스(10월)과 비슷한 시기 유럽에 허셉틴 바이오시밀러 'CT-P06' 허가 신청을 한 셀트리온(11월)도 연내 권고를 받을 것으로 예상된다.
녹십자는 빠르면 연내 미국에서 1차성 면역결핍질환 치료제인 'IVIG-SN'의 판매 허가를 받을 것으로 관측되고 있다. 녹십자는 2015년 말 미국에 IVIG-SN 허가 신청서를 제출했고, 지난해 말 제조공정 자료를 보완해달라는 요청을 받았다. 제조공정 문제로 승인을 못받는 경우는 드물고 제품 유효성이나 안정성에 대한 문제제기가 없었던 만큼, 자료 제출 후 허가에는 차질이 없을 것이란 기대다.
시판까진 시간이 남았지만, 연말까지 임상도 대거 진척된다. 한미약품이 대표적인 예다. 한미약품이 연내 다국적 제약사인 사노피에 기술수출한 당뇨병 신약 '에페글레나타이드(LAP-GLP1)'의 임상3상(4분기)이 개시되고, 얀센에 기술수출한 당뇨·비만 치료제 'NJ-6456511'의 미국 임상1상도 시작된다. 모두 지난해 말 임상용 의약품 공급에 차질이 생겨 임상이 중단됐던 것들이다.
이 중 에페글레나타이드는 사노피가 지난해 말 계약 해지·변경한 지속형 당뇨신약 3건(퀀텀 프로젝트) 기술수출 계약 중 하나다. 당시 사노피는 계약 1건(지속형 인슐린)을 해지하고, 나머지(에페글레나타이드·에페글레나타이드+인슐린)는 개발 과정에서 한미약품이 비용을 일부 부담하는 것으로 조건을 변경했다. 이후 임상이 중단돼 우려가 쏟아졌지만, 재개되면서 긍정적인 평가를 받고 있다.
또 종근당은 다국적 제약사인 머크의 고지혈증 치료제 아나세트라핍 임상3상 결과 발표를 주목하고 있다. 아나세트라핍이 상용화에 성공하면, 유사물질인 종근당의 CKD-519이 성공 가능성도 높아지기 때문이다. 이 후보물질은 현재 호주에서 임상2a상을 하고 있이다. 여기에다 종근당의 자가면역질환 치료제 'CKD-506'도 유럽에서 임상1상 중이다. 연말 종료돼 내년초 결과가 발표될 예정이다.
최근 최태원 회장의 장녀가 입사하면서 주목을 받은 SK바이오팜도 연내 미국에 뇌전증 치료제 'YKP3089(세노바메이트)', 수면장애 치료제 'SKL-N05'의 신약 허가를 신청하는 것을 목표로 세워놨다. 현재 YKP3089는 임상3상을 진행 중이며, SKL-N05는 최근 임상3상을 완료했다. SK바이오팜은 신약 출시 시기에 맞춰 내년쯤 기업공개도 추진할 계획이다.
[뉴스핌 Newspim] 박미리 기자 (milpark@newspim.com)
 영상
영상