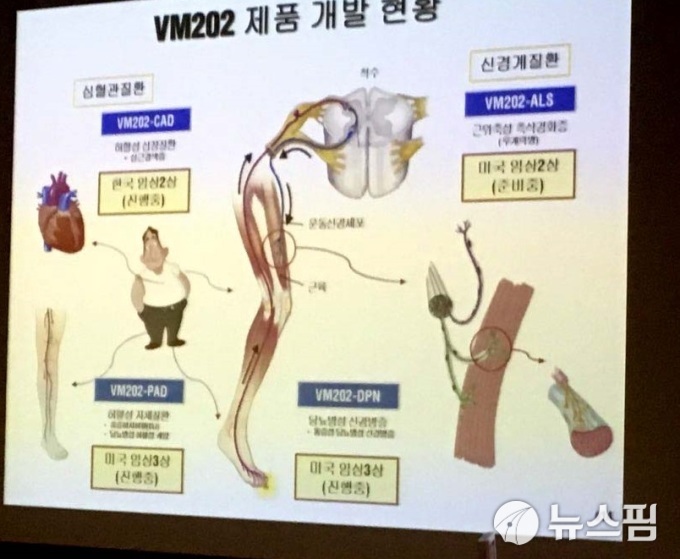
[서울=뉴스핌] 김유림 기자 = 바이로메드가 개발 중인 유전자치료제 VM202 파이프라인 중 미국 임상 2상 승인을 받고도, 오랫동안 계류 중인 치료제가 있어 이목이 쏠리고 있다.
1일 바이로메드와 이연제약 측에 따르면 근위축성 측삭경화증(루게릭병) 치료제 파이프라인 ‘VM202-ALS’의 미국 임상 2상 시험 시작이 수년 동안 미뤄지고 있다.
앞서 VM202-ALS는 지난 2016년 FDA(미국 식품의약국)로부터 임상 2상 실시 허가를 받았다. 당시 바이로메드 측은 “84명의 피험자를 대상으로 미국 내 10개 병원에서 임상 2상을 실시한다”고 밝혔다.
또 이듬해 바이로메드와 이연제약은 루게릭병 환자들을 대상으로 진행한 미국 임상 1/2상 결과를 국제학술지 ‘Amyotrophic Lateral Sclerosis and Frontotemporal Degeneration’에 출판하기도 했다.
하지만 양사의 공동개발에 문제가 생기면서, VM202-ALS는 FDA 승인 문턱을 넘고도 2년 넘게 “준비 중”이다. 어제의 동지가 오늘의 적이 된 형국이다.
이연제약 측은 이와 관련 “원인은 바이로메드에 있다”고 전했다.
금감원 전자공시시스템에 따르면 바이로메드는 2004년 VM202에 대한 공동연구개발계약을 이연제약과 체결했다. VM202를 이연제약에 기술을 이전했고, 이 제품의 국내 판매권을 허여한 대가로 기술료 및 상용화 비용을 받으며, 제품 출시 후 총 매출액의 일정 비율을 경상기술료로 받기로 계약했다고 공시됐다.
그러나 양사는 당시 체결한 계약을 두고 해석을 다르게 했다.
이연제약은 “VM202 국내 독점 판매권과 전 세계 원료공급권을 보유하고 있다”고 보고 있으며, 바이로메드는 “특정 질환과 프로젝트, 한국 것만 해당한다. 이연제약의 주장일 뿐”이라는 입장이다.
두 기업은 지난해부터 소송을 벌였고, 대한상사중재원에 중재신청을 요청하는 등 평행선을 달리고 있다. 루게릭병 파이프라인 임상 2상 역시 이 과정에서 중단된 셈이다.
바이로메드 관계자는 이와 관련 “할 말이 없다. 이연제약과 관련한 것은 언론 대응을 하지 않는 게 내부 지침”이라고 말했다.
urim@newspim.com
 영상
영상