[서울=뉴스핌] 김영섭 기자 = 질병의 원인이 되는 DNA를 유전자 가위로 교정하는 기술이 유전자 치료제로 개발되기 위해서는 유전자 가위가 생체 조직 안으로 면역 부작용 없이 정확하고 안전하게 표적하는 기술이 매우 중요하다.
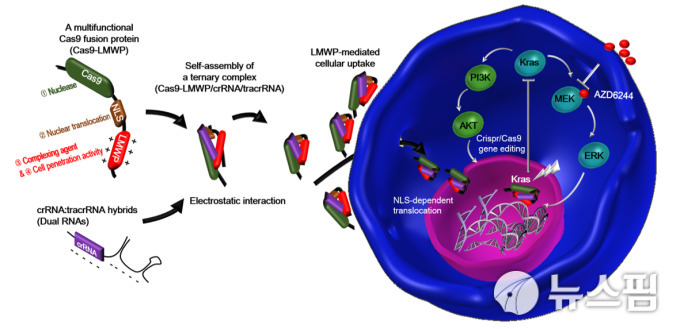
국내 연구진이 자가 조립이 가능하고 외부의 전달체 없이 안전하게 암 생체 조직으로 전달 가능한 자가조립형 유전자 가위 시스템을 개발했다.
8일 한국과학기술연구원(KIST·원장 이병권)에 따르면 KIST 의공학연구소 생체재료연구단 오승자 박사팀과 테라그노시스연구단 장미희 박사팀은 외부의 전달체 없이 자가조립이 가능하도록 유전자 교정 핵심 단백질(Cas9)을 개량, 안전성이 높고 생체 조직 내의 표적이 용이해 암을 치료할 수 있는 '크리스퍼 유전자 가위(CRISPR-Cas9)' 기술을 개발했다.
연구진은 유전자 가위를 체내에 직접 넣는 '인비보(In-vivo)' 방식을 활용했다.
기존의 유전자 가위를 생체 조직으로 전달하는 기술은 인지질로 구성된 양이온 리포좀(Cationic liposome)을 통한 전하 복합체의 형성에 의해 전달이 가능했다. 이로 인해 의도치 않은 면역원성을 유발하고 세포 독성이 높아 임상 연구로 진행되기엔 한계가 있었다. 양이온 리포좀내 유전자 가위를 캡슐화할 때 포착 효율이 좋지 않다는 단점도 갖고 있다.
연구진이 개발한 자가조립형 유전자 가위 기술은 외부의 전달체 없이 유전자 가위를 암 세포막 안으로 스스로 전달 가능하도록 하는 기술로, 핵까지 스스로 이동한 유전자 가위가 유전체를 교정하는 메커니즘을 갖는다.
KIST 연구진은 ‘Cas9’ 단백질의 서열 ‘C’ 말단 부위(c-terminus)를 음전하를 띠고 있는 sgRNA와 자가조립이 가능하도록 양전하로 구성된 자연 유래의 펩타이드 서열(LMWP, Low molecular weight protamine)과 핵으로 이동이 가능한 서열(NLS, Nuclear localization signal)을 갖도록 설계했다.
교신저자인 오승자 박사는 “이번 기술은 암을 포함한 난치성 유전 질환에 적용 가능한 플랫폼 기술로, 질병을 유발하는 유전자를 편집해 교정하는 기술에 활용이 가능하다”며 “이후 지속적인 지원과 연구가 이어진다면 동·식물 개량 등 향후 유전자 조작이 필요한 전 분야에 응용 확장 가능한 기술로 발전될 수 있다”고 밝혔다.
이번 연구결과(논문명 ‘Simple in Vivo Gene Editing via Direct Self-Assembly of Cas9 Ribonucleoprotein Complexes For Cancer Treatment)는 국제 과학저널인 ‘ACS Nano’ 최신호에 게재됐다.
kimys@newspim.com
 영상
영상