[서울=뉴스핌] 김근희 기자 = '발암물질 논란 고혈압약' 제품을 복용한 환자들의 추가 발암 가능성이 매우 낮은 것으로 조사됐다.
식품의약품안전처는 모든 발사르탄 원료의약품에 대한 'N-니트로소디메틸아민(NDMA)' 수거·검사를 완료한 이후, 발사르탄 복용환자에 대한 추가 발암 가능성 평가를 실시한 결과를 19일 발표했다.
앞서 지난 7월 중국 화하이사에서 생산한 원료의약품 '발사르탄'을 사용한 고혈압약에서 발암가능물질인 NDMA가 검출되면서, 관련 제품이 회수·판매 중지되는 등 논란을 빚었다.
이후 식약처는 NDMA가 검출됐던 화하이 발사르탄 사용 완제의약품을 실제로 복용한 환자의 개인별 복용량과 복용기간을 토대로 발암 가능성이 얼마나 높아지는지 계산했다.
평가 결과 복용환자 10만명 중 약 0.5명이 전 생애동안 평균 암발생률에 더해 추가로 암이 발생할 가능성이 있는 것으로 계산됐다. 이는 국제의약품규제조화위원회(ICH) 가이드라인 기준인 10만명 중 1명 이하 보다 낮은 수준이다. 참고로 2015년 국가암등록통계 기준으로 국내 연간 암발생 환자는 10만명 중 421.4명이다.
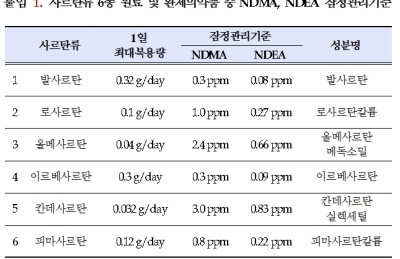
또 식약처는 사르탄 계열 의약품의 NDMA와 또 다른 발암가능 물질인 N-니트로소디에틸아민(NDEA) 검출 여부 등에 대하여 단계적으로 조사를 진행 중이다.
국내 유통되는 발사르탄 의약품 전체에 대한 NDEA 검사 결과, 스페인의 '퀴미카 신테티카 발사르탄'이 NDEA 잠정 관리기준을 초과했다. 그러나 해당 품목은 앞서 NDMA가 검출돼 이미 판매가 중지된 제품이다.
중국 화하이사로부터 수입한 사르탄계열 원료의약품 중 이르베사르탄 및 올메사르탄은 NDMA와 NDEA 모두 잠정 관리기준 이하였다. 화하이사 로사르탄의 경우 2014년 이후 수입‧유통된 전체 제조번호에 대해 검사한 결과, NDMA는 불검출이었으며, NDEA의 경우 완제의약품 1개 품목의 1개 제조번호만 잠정 관리기준(0.27ppm)을 벗어나는 것으로 확인됐다.
NDEA가 잠정 관리기준 이상 검출된 제품은 일양약품의 '일양로자탄정'(제조번호 15004)으로, NDEA가 0.397ppm 검출됐다. 해당 제품은 유효기간은 오는 23일 만료 예정으로, 현장 점검 결과 약국에서 더 이상 조제‧판매가 이루어 질 가능성은 없는 것으로 확인됐다. 식약처는 해당 제조업체에게 재발방지 등 후속 조치를 취하도록 했다.
식약처 관계자는 "문제가 된 일양로자탄정을 1일 최고용량인 100mg씩을 유효기간인 3년간 계속 복용하더라도 추가 발암가능성은 10만명 중 0.06명에 그친다"며 "ICH 가이드라인에 따르면 인체에 미치는 위해 우려는 거의 없는 수준"이라고 말했다.
이밖에, 해외 안전성 정보가 입수된 인도 헤테로사 로사르탄과 인도 아우로빈도사 이르베사르탄은 NDMA 및 NDEA가 잠정 관리기준 이하이거나 국내 수입실적이 없는 것으로 조사됐다.
또 식약처는 중국 화하이사 제조소에 대한 현지실사를 지난달 26일부터 29일까지 진행했다. 사르탄 계열 제조품질관리 등 전반을 조사했고, 발사르탄 등 제조에 사용하는 원료물질(DMF, TEA 등) 공급자에 대한 체계적 평가 및 제조공정 밸리데이션 등이 일부 미흡하여 보완이 필요한 것으로 나타났다. 앞으로 원료의약품 관리와 변경 관리에 있어 철저를 기하도록 후속 조치할 예정이다.
식약처 관계자는 "앞으로도 지속적으로 국내·외 사르탄계열 의약품에 대한 불순물 모니터링 및 각종 선제적·예방적 불순물 관리체계를 마련하겠다"며 "안전한 의약품만이 소비자에게 공급될 수 있도록 엄격히 관리할 계획"이라고 했다.
이에 따라 식약처는 유럽, 스위스, 미국 등 각국 규제기관과 위해 정보 공유 체계를 유지할 계획이다. 또 식약처 연간 품질 모니터링 대상에 사르탄 계열 NDMA 등 시험 항목을 포함하여 주기적으로 확인한다.
이외에도 △발사르탄 NDMA 관련 공정검증 등 자료 제출 및 검토 △신규 허가 시 불순물 관련 자료 제출 의무화를 위한 규정 개정 △원료의약품 업체 NDMA 등 적정관리 여부에 대한 완제의약품 제조업자의 평가를 강화한다.
또 국내·외 의약품 제조소에 대한 선택과 집중을 통한 점검을 강화하고, 연구사업을 통해 추가적인 불순물에 대한 조사, 시험법 마련 및 관리방안 등을 마련해 나갈 계획이다.
keun@newspim.com
 영상
영상