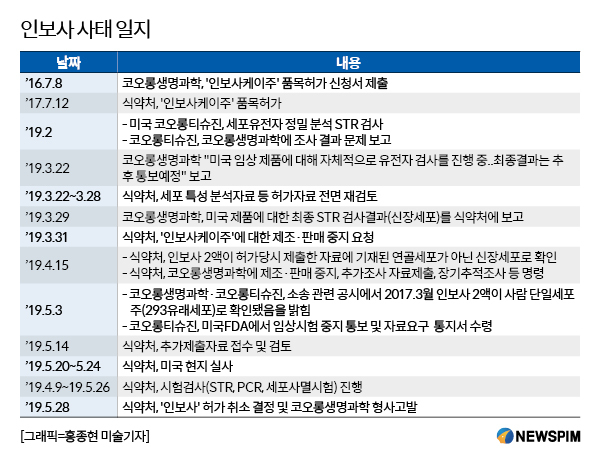
[서울=뉴스핌] 박다영 기자 = 28일 국내 품목허가 취소 처분을 받은 코오롱생명과학 '인보사케이주(한국 제품명 인보사)'가 미국에서 임상 3상을 재개하기 위한 준비 단계를 밟을 예정이다.
코오롱생명과학 관계자는 "미국 임상 3상 재개를 위해 오는 6월 내로 미국 식품의약국(FDA)가 요구한 서류를 모두 제출할 계획"이라고 말했다. 미국 임상시험을 재개해 미국 시장에서 인보사를 판매하겠다는 방침인 것으로 풀이된다.
인보사는 사람 연골에서 추출한 연골세포(HC)가 포함된 1액과 연골세포 성장인자(TGF-β1)를 도입한 형질전환세포(TC)가 담긴 2액을 3대 1로 섞어 관절강 내에 주사하는 세포 유전자 치료제다.
2017년 7월 세계 최초의 유전자 치료제, 국산신약 29호로 식약처의 허가를 받았다.
미국에서 임상 3상을 진행하던 도중 인보사는 2액 세포가 연골 세포가 아닌 신장유래세포(293세포)라는 것이 밝혀져 유통·판매가 중단됐다.
식약처는 이날 인보사 2액 세포에 대한 조사 결과, 코오롱생명과학이 허가 당시 제출한 자료에 하자가 있었다고 판단해 품목허가를 취소하고 코오롱생명과학에 대해 형사고발하겠다고 밝힌 바 있다.
allzero@newspim.com
 영상
영상