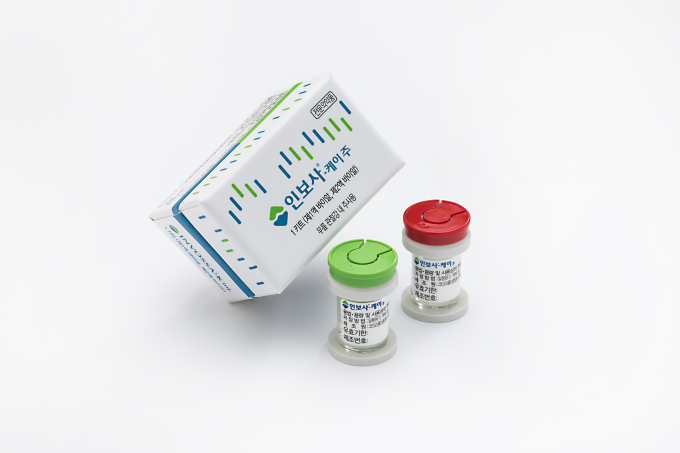
[서울=뉴스핌] 박다영 기자 = 품목 허가 취소의 갈림길에 놓인 코오롱생명과학 '인보사케이주'(한국 제품명 인보사)의 미국 임상 3상 재개를 위한 자료 제출이 당초 계획했던 일정보다 지연될 것으로 보인다.
코오롱생명과학은 지난 5월 "미국 임상 3상 재개를 위해 오는 6월 내로 미국 식품의약국(FDA)가 요구한 서류를 모두 제출할 계획"이라고 밝힌 바 있다.
코오롱생명과학 관계자에 따르면, FDA 임상 3상 재개를 위한 자료 중 외부 검토가 필요한 일부 자료의 준비가 늦어졌다.
회사 측은 7월 중순까지 필요한 자료 제출을 완료할 수 있을 것으로 예상하고 있다. 다만, 8월까지 FDA가 휴가기간이기 때문에 자료 제출이 8월로 연기할 가능성에 대해 내부적으로 검토할 예정이다.
코오롱생명과학 관계자는 "7월 중순까지는 자료 제출을 완료할 수 있는데, FDA가 8월까지 휴가기간인 것으로 안다"며 "따라서 내부 논의를 거쳐 7월 중순이나 FDA 휴가 이후로 자료 제출을 연기할 수 있을 것으로 예상된다"고 말했다.
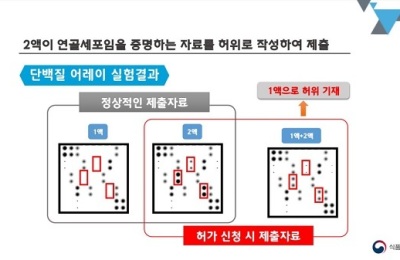
인보사는 미국에서 임상 3상을 진행하던 도중 허가 당시 제출한 자료와 다른 성분이 들어있다는 사실이 드러나 식품의약품안전처로부터 품목허가 취소 처분을 받았다. 식약처는 지난달 품목허가 취소와 관련 코오롱생명과학의 의견을 청문했고, 최종 결정을 앞두고 있다.
allzero@newspim.com
 영상
영상