[서울=뉴스핌] 김유림 기자 = # 임상 3상은 예정대로 잘 진행되고 있습니다. 효능 면에서는 아직 이중맹검 상태라 명확히 말씀드릴 수 없지만 흥미로운 현상(observation)들이 관찰됐습니다. 규제 이슈를 점검하고 공개 발표의 적법성과 적합성을 살핀 후, 적절한 시기와 장소에서 밝히도록 하겠습니다.(지난 7월 헬릭스미스 IR레터)
헬릭스미스(구 바이로메드)가 유전자치료제 엔젠시스의 당뇨병성 신경병증 글로벌 임상 3상 결과를 발표조차 하지 못했다. 일부 환자에게서 위약과 약물의 혼용 가능성이 발견됐다는 이유에서다.
회사 측이 수시로 공식 홈페이지를 통해 임상 3상이 순조롭게 진행되고 있고, 흥미로운 현상들이 관찰되고 있다고 밝혀온 만큼 이번 사태에 대한 의구심이 커지고 있다. 코스닥 시가총액 2위이며 소액주주의 비율이 84%에 달하는 종목인 만큼 시장에 미치는 파급이 상당할 것으로 예상된다.
24일 오전 8시 30분 헬릭스미스가 서울 여의도에 위치한 NH투자증권 본사 4층 강당에서 기관 및 개인투자자, 기자를 대상으로 기업설명회(IR)를 개최한다. 실시 목적은 엔젠시스 당뇨병성 신경병증(VM202-DPN) 임상 3상(3-1) 현황 및 결과 보고다.
당초 헬릭스미스는 VM202-DPN 글로벌 임상 3상 탑라인 데이터를 9월 말 발표할 예정이었고, 지난 23일 저녁 6시 9분 데이터 자체 분석 결과를 금감원 전자공시시스템에 공시했다.
회사 측은 “DPN 임상 3상 일부 환자에서 위약과 약물 혼용 가능성이 발견됐다”며 “현재의 데이터만으로는 혼용 피험자에 대한 정확한 확인이 불가능, 별도 조사가 필요한 상황으로 11월에 제출할 최종보고서와 12월로 예상되는 임상 3상 종료 미팅에서 상세하게 미국식품의약국(FDA)에 보고할 예정이다”고 전했다.
◆ 위약 복용 환자에게서 어떻게 약물이 검출됐나
헬릭스미스는 2015년 4월 VM202-DPN 미국 임상 3상을 FDA로부터 승인받았다. 통증을 동반한 당뇨병성신경병증 환자에 투여한 VM202의 안전성과 유효성을 평가하기 위한 이중맹검 방식의 시험이다.
오픈라벨(open-label)은 피험자와 시험자 모두 시험약과 대조약 중 어떤 약을 사용했는지 알고 진행하는 방식이다.
이중맹검(double blind) 방식은 피험자인 환자와 연구자인 의료진 모두 임상이 끝날 때까지 시험약과 대조약 중 어떤 약을 투여했는지 모른다. 절반은 효능이 있는 약과 동일하게 생겼지만 아무 효과도 없는 위약, 나머지는 진짜 약을 투여해 비교 시험한다. 위약을 먹고 약효가 있다고 믿으면서 오는 물리적 효과를 ‘플라시보(placebo)’라고 한다.
현직 임상대행업체 직원은 “약물이 혼용된 사례는 처음 들어본다. 시험약에는 각 시리얼번호가 있고, 투여하는 의사가 환자와 해당 번호를 철저히 확인하고 투여를 한다”며 “의사와 간호사가 크로스 체크를 하고 공동 서명을 하고 투여를 하기 때문에 약이 잘못 들어가는 경우는 일어나기가 어렵다. 도대체 어떤 경위로 이런 중대한 실수가 발생했는지 궁금하고, 임상 업계에서도 주목하고 있다”고 말했다.
◆ 여러 변수에 대비한 프로토콜 및 통계법이 없는 건가
바이오기업 고위 관계자는 “임상 참여 병원의 의사라 할지라도 환자가 우선이다. 헬릭스미스 임상은 통증 완화 효능을 보는데, 환자가 심한 통증을 호소할 경우 중간에 다른 약을 처방해 줄 수도 있고 의료 기록에 다 남는다”며 “임상시험은 환자를 대상으로 하므로 항상 여러 변수가 발생한다. 글로벌 빅파마들은 모든 변수를 임상 디자인에 넣고 통계학적으로 결과를 도출할 수 있도록 만들어 놓는다”고 설명했다.
FDA 등 보건당국에 제출하는 임상계획서에 결측치(Missing Value)에 대한 대응 방안이 기재되어있다면, 분석 후 결과 도출이 가능하다. 결측치는 말 그대로 데이터에 값이 없는 것을 뜻한다.
핵심은 임상계획서에 결측치에 대한 합리적인 통계방법론이 명확히 제시되어 있어야 한다. 결측치 발생형태 경향을 파악해 처리방법을 정의하고, 처리방법에 따라 결과가 어떻게 달라지는지 민감도 분석도 필요하다. 계획서에 결측치 처리 방법의 변경이 필요하거나 새로운 정의 추가가 필요할 경우 관련 검토내용을 문서화하고 계획서변경 또는 통계분석계획에 반영하면 된다.
헬릭스미스가 VM202-DPN 미국 임상 3상에서 이러한 문제가 발생했을 경우 어떻게 대처할 것인지 프로토콜을 디자인해 임상계획서에 명기했는지 주목할 필요가 있다.
◆ 위약과 약물의 뒤섞임, FDA 설득할 수 있나
헬릭스미스 측은 “피험약 혼용 가능성으로 플라시보와 엔젠시스의 효과가 크게 왜곡되어 명확한 결론 도출이 불가능하다”며 “다음 임상 3상(3-2)은 향후 6개월 내에 시작하여 2021년 말~2022년 1분기 사이에 모두 종료하는 것을 목표로 한다”고 밝혔다.
이어 “다음 임상시험을 보다 정밀하고 효율적으로 관리하는 방안을 마련 중이다. 예를 들어 지금보다 2~3배 작은 규모로 2~3개 진행하는 것이다”며 “임상시험 신뢰성보증 조직(Clinical Quality Assurance, CQA) 전문가 레너드 피쉬(Leonard Fish) 박사를 단장으로 하는 조사단을 구성해 정밀 조사를 시작했다”고 덧붙였다.
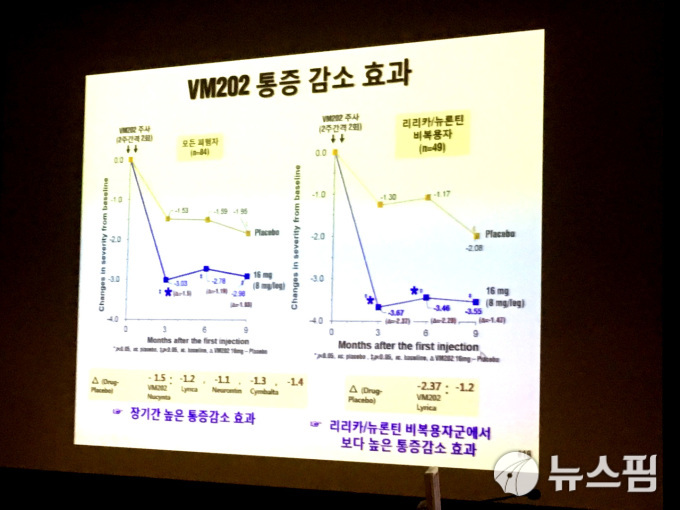
VM202-DPN은 당뇨병성신경병증 환자에게서 통증 완화 효능을 보기 위해 미국 임상이 진행됐다. 리리카, 뉴로틴 등 기존에 처방되고 있는 약물보다 통증 완화 효과가 더 오래간다는 측면에서 시장성이 높다고 평가받았다.
하지만 헬릭스미스는 이번 임상에서 유의미한 통계조차 내지 못했다. 특히 항암제, 불치병치료제 등과 달리 현존하는 약물이 있고, 환자의 목숨을 다툴만한 약물이 아니라는 점에서 불리한 상황이다. 일부 효능을 보인 환자 데이터를 통해 FDA의 후속 임상 승인을 받아낸다는 계획이 성공할지 관심이 집중된다.
urim@newspim.com
 영상
영상