[서울=뉴스핌] 박다영 기자 = 식품의약품안전처가 신종 코로나바이러스 감염증(코로나19) 치료제·백신의 신속 개발을 위해 임상 시험 심사기간을 15일 이내로 단축한다. 사용 경험이 있는 물질의 경우 7일 이내, 신물질의 경우 15일 이내에 임상시험 심사를 받을 수 있다.
식품의약품안전처는 신종 코로나바이러스 감염증(코로나19) 치료제·백신의 신속 개발을 위해 연구, 허가심사 등 전주기를 지원하는 '고강도 신속 제품화 촉진 프로그램'(고(GO)·신속 프로그램)을 운영한다고 13일 밝혔다.
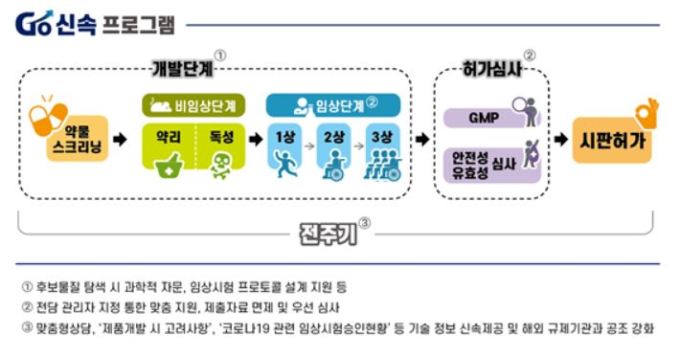
고(Go)·신속프로그램은 연구개발·임상승인·허가심사·정보공유·국제공조에 대한 차별화된 지원전략이다. 제품의 효과와 안전성은 확보하면서 각 단계별 시행착오는 최소화해 개발기간을 단축하는 것이 주요 내용이다.
구체적으로 고(Go)·신속 프로그램을 통해 식약처는 ▲연구 지원 ▲허가심사 지원 ▲기술정보 지원 ▲협력 지원 등을 진행한다.
연구지원은 정부·출연연구소가 진행하는 후보물질 탐색 시 제품화 가능성 있는 물질을 결정하는 과정에서 과학적 자문을 제공한다. 개발자들이 제품 효능평가 시 활용할 수 있도록 코로나19 바이러스 감염 동물모델을 개발·공유하고 치료제·백신 임상프로토콜 개발 등을 지원한다.
허가심사 지원은 연구개발부터 허가심사 전 단계에 걸친 코로나 19 전담 상담창구를 개설함으로써 이뤄진다. 치료효과를 기대할 수 있는 품목에 대해 전담관리자를 지정하고 개발단계별로 맞춤 지원한다. 안전성이 입증된 플랫폼을 사용하여 개발한 백신은 독성시험을 면제해 최소한의 자료 제출로 임상시험에 진입할 수 있게 된다.
또한, 경험 있는 심사자로 구성된 심사팀을 운영해 사용 경험이 있는 물질의 경우 7일 이내, 신물질의 경우 15일 이내로 임상시험 심사기간을 획기적으로 단축한다. 허가 시에도 우선적으로 신속하게 처리할 예정이다.
기술정보 지원은 임상시험 설계 방법 등의 내용을 담은 '코로나19 치료제 개발 시 고려사항' 및 임상시험 중 자주 묻는 질의·응답 등의 정보를 제공한다. 치료제와 백신 임상시험 승인현황은 신속히 공개한다.
또한, 의약품 규제기관 국제 연합(ICMRA) 등 국제적 공조를 통해 협력지원을 제공한다. 각국에서 진행되는 임상시험 및 심사정보를 공유하고 개발자들이 제품 개발과정 중 발생하는 애로사항이나 질의사항을 즉각적으로 해소할 수 있도록 '제품화지원팀장'과 핫라인을 설치·운영한다.
식약처 관계자는 "산업계, 학계, 연구소, 병원 등과 협력해 안전하고 효과 있는 치료제와 백신을 신속히 개발할 수 있도록 모든 역량을 모아 최선을 다하겠다"라고 말했다.
allzero@newspim.com
 영상
영상