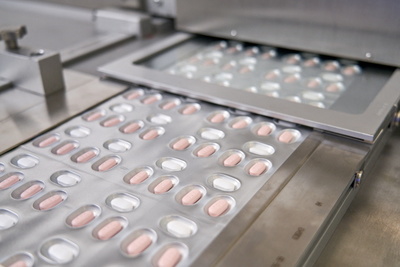
[서울=뉴스핌] 최원진 기자= 미국 식품의약국(FDA)이 22일(현지시간) 세계 최초의 신종 코로나바이러스 감염증(코로나19) 경구용 항바이러스제 긴급사용을 승인했다.
긴급사용 승인을 받은 약은 화이자 개발의 '팍스로비드'인데, 이보다 먼저 긴급사용 승인을 신청한 머크앤컴퍼니의 '몰누피라비르'의 승인 여부는 아직 미정이다.
팍스로비드의 경우 FDA 긴급사용 여부 결정 전 자문위원회의 회의 절차도 넘기고 신속 승인한 사례다. 화이자는 지난달 16일 긴급사용 승인을 신청했다면 머크는 이보다 빠른 지난 10월에 신청서를 제출했다. 지난달 30일 FDA 향균의약품자문위의 긴급사용 승인 권고도 받았다. 그러나 무슨 이유에서인지 당국의 승인이 지연되고 있다.
전날 블룸버그통신은 복수의 소식통을 인용, FDA가 이르면 이날 화이자와 머크 알약 긴급사용 승인을 발표할 것이라며, 이번 주 안에는 결정이 나온다고 보도하기도 했다.
몰누피라비르 긴급사용 승인 지연에 자문위의 팽배한 찬반 의견이 영향을 끼친 것이 아니냐란 관측이 나온다. 자문위는 몰누피라비르 긴급사용 승인 권고안 표결에서 찬성 13표-반대 10표로 팽배하게 갈렸다. 논쟁이 된 것은 몰누피라비르의 예상보다 못한 효능이다.
머크는 초기 임상시험에서 경증의 코로나19 환자가 800㎎ 알약을 매 12시간 마다 5일 동안 복용하면 중증 악화 및 사망률이 50%로 감소한다는 결과를 발표했다. 알약은 복용이 간편하고 집에서도 치료할 수 있다는 점에서 팬데믹 종식의 '게임체인저'(game changer)로 평가받았다.
그러나 대규모 시험참가자를 대상으로한 최종 임상에서 효능이 떨어지는 것으로 확인됐고, FDA도 임상시험 데이터 분석 결과 30%만 효능이 있다고 확인한 것이다.
몰누피라비르가 바이러스 변이를 부추길 수 있다는 가능성도 제기됐다. 몰누피라비르는 바이러스 유전 물질과 결합해 변이를 일으켜 바이러스가 복제하고 확산하는 것을 막아 결국에는 자멸시키는 원리로 작용하는 데, 약이 대량 유통되면 바이러스가 기존의 백신과 치료제 효능을 회피하는 방향으로 변이할 수 있다는 우려가 일각에서 제기됐다.
CNBC에 따르면 제임스 힐드레스 메헤리 의과대학법인 이사장은 "비록 1만분의 1 더 나아가 10만분의 1 가능성이라도 이 약이 회피성 돌연변이를 일으킨다면 전 세계에 잠재적으로 재앙적일 것"이라고 FDA 자문위에 의견을 냈다.
아울러 몰누피라비르는 임신부 복용이 권고되지 않는다는 점도 부정적인 요인이다. 실험용 쥐 임상 결과 태아에 선천적 기형 부작용을 일으킬 수 있다는 결과가 나왔기 때문이다. 머크는 애시당초 몰누피라비르의 임산부 복용을 염두해두지 않았다는 입장이다.
그러나 코로나19 알약의 장점 중 하나가 기저질환이나 임신 등을 이유로 백신 접종을 꺼리는 이들에게 대체제라는 것인데 임신부가 복용할 수 없다는 것은 분명 단점이다.
FDA 자문위원인 폴 오핏 필라델피아소아과병원의 백신교육센터장은 "(팍스로비드는) 백신 접종을 거부하는 4000~5000만명의 미국인이 복용한다면 이들의 감염 후 입원을 방지할 것"이라고 말했다.
팍스로비드의 중증·사망 예방은 89%다. 미 질병통제예방센터(CDC)의 긴급사용 승인까지 받으면 빠르면 이번 주말부터 미국 시중에 유통될 것으로 전망된다.
몰누피라비르는 우리 정부가 40만여분을 구입해 내년 2월에 도입할 계획인 약이기도 하다. 프랑스 정부는 이날 효능 미달을 이유로 머크 치료제 구매 계약을 취소했다.
wonjc6@newspim.com
 영상
영상