[서울=뉴스핌] 방보경 기자 = 셀트리온이 휴미라 바이오시밀러 '유플라이마'의 미국 승인이 오는 5월까지 완료될 거라고 밝혔다. 경쟁사들이 허가를 받은 상황에서, 셀트리온만 미국 시장 진출이 늦을 거라는 지적에 대응한 셈이다.
셀트리온은 23일 '유플라이마 FDA 승인 지연 관련 주주님께 알리는 글'에서 유플라이마의 미국 FDA 승인 지연과 관련해 입장을 밝혔다. 유플라이마(CT-P17)는 셀트리온의 자가면역질환 치료제로, 유럽과 한국에서는 판매되고 있으며 미국 진출 준비중이다.
셀트리온은 "유플라이마의 완제를 담당하는 해외 완제 의약품 제조소에 대한 FDA on-site 실사에서 지적사항이 있었다"고 설명했다.
이어 "이를 시정하기 위한 제조소의 조치 및 재실사를 통한 FDA의 확인이 필요했고, 이것이 유플라이마 BLA(Biologics License Applications) 검토 기간 동안 완료되지 않아 허가 지연이 발생했다"고 했다.
셀트리온은 "현재는 해당 제조소가 최종적으로 FDA로부터 적합 등급(VAI, Voluntary Action Indicate)의 판정을 받아 모두 해결됐다"며 "당사는 FDA와 협의를 지속하면서 유플라이마의 최종 승인 검토를 오는 5월까지 완료하는 것으로 확인했다"고 덧붙였다.
FDA는 실사에서 NAI, VAI, OAI 등의 결정을 내린다. NAI(No Action Indicated)는 문제가 없을 때 내리는 결론으로, FDA 검사의 절반 이상이 이렇게 분류된다. OAI(Official Action Indicated)를 받을 경우 경고장, 명령, 기소 등의 조치를 받게 된다.
셀트리온이 언급한 'VAI'는 불합리한 사항들이 발견됐지만 위반 내용이 심각한 수준이 아닐 경우 제조소 자발적으로 시정조치를 요청할 때 부여되는 등급을 의미한다.
한 업계 관계자는 "제조소가 승인된 다음에도 문제가 된 항목에 대해서는 매년 다시 검사하는 걸로 알고 있다"고 말했다.
한편 셀트리온그룹은 오리지널사와 특허 합의를 마쳐 오는 7월 1일부터 미국에서 유플라이마를 판매할 예정이지만, FDA 허가를 받지 못한 상태다.
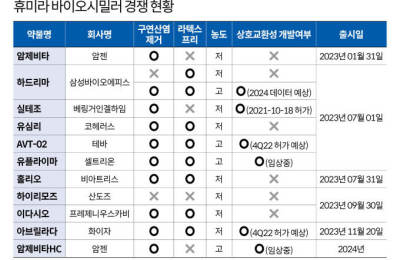
올해 휴미라 바이오시밀러를 출시하는 제약사 중 삼성바이오에피스, 베링거인겔하임, 코헤러스, 비아트리스, 산도즈, 프레제니우스카비, 화이자 등은 FDA의 허가를 받았다. 특히 삼성바이오에피스와 베링거인겔하임, 코헤러스는 오는 7월1일에 제품을 내놓는다.
hello@newspim.com
 영상
영상