[서울=뉴스핌] 김근희 기자 = 바이오 벤처 안트로젠이 당뇨병성족부궤양 줄기세포치료제(ALLO-ASC-SHEET)의 개발 일정 목표를 5개월 이상 미룬 것으로 드러났다. 임상시험 계획을 변경하면서 일정이 늦춰진 것으로 보인다.
안트로젠은 18일 오후 서울 금천구 본사에서 기관 투자자들을 대상으로 기업설명회(IR)를 개최했다.
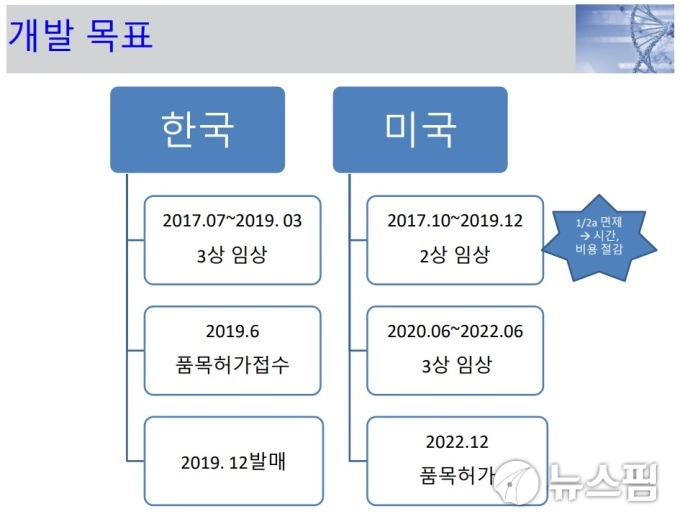
이날 공개된 IR자료에 따르면 안트로젠이 개발하고 있는 당뇨병성족부궤양 줄기세포치료제의 국내와 미국 임상시험 일정이 각각 9개월과 5개월씩 미뤄졌다.
안트로젠은 지난해 7월 식품의약품안전처로부터 당뇨병성족부궤양 치료제의 임상 3상 계획(IND)을 승인받았다. 이후 같은해 10월 미국 식품의약국(FDA)으로부터 임상 2상 IND의 허가를 받았다.
당초 회사는 당뇨병성족부궤양 줄기세포치료제의 국내 임상 3상을 올해 10월까지 마치고, 12월에 품목허가를 접수할 방침이었다. 이후 내년 3월 국내에 치료제를 발매할 계획이었다.
그러나 이날 안트로젠은 당뇨병성족부궤양 줄기세포치료제의 임상 3상 종료 시점을 내년 3월, 품목허가 시점을 내년 6월로 미뤘다. 발매 시점도 내년 12월로 늦춰졌다.
내년 4월 종료 예정이었던 미국 임상 2상도 내년 12월로 미뤄졌다. 내년 5월께 시작해 2022년 4월에 완료될 계획이었던 미국 임상 3상 계획은 2020년 6월 개시, 2022년 6월 종료로 바뀌었다. 미국 품목허가는 2022년 7월에서 2022년 12월로 늦춰졌다.
안트로젠이 임상시험 계획을 변경하면서 이처럼 개발 일정이 바뀐 것으로 보인다. 회사는 현재 국내 임상 3상과 미국 임상 2상의 시험 계획을 변경하고 이를 관련 허가당국과 협의 중이다.
안트로젠 고위 관계자는 "현재 한국과 미국의 임상시험 계획을 변경 중에 있다"며 "이 과정이 끝나야 임상시험 개시가 가능하다"고 말했다.
통상적으로 회사가 임상시험 계획을 승인 받더라도, 업체는 전략변경이나 여러 필요에 따라 임상시험 계획을 변경할 수 있다. 이 경우 허가 당국에 임상시험계획 변경승인을 받아야 한다. 변경승인이 떨어져야 환자를 모집하고, 임상시험을 진행할 수 있다.
이날 코스닥시장에서 안트로젠의 주가는 전날 종가보다 3만7400원, 21.24% 하락한 13만8700원을 기록했다. 지난 13일 종가(19만7700원)보다 30% 하락한 수준이다. 16일 장중 고점인 23만8000원에서 40% 넘게 내렸다.
keun@newspim.com
 영상
영상