[서울=뉴스핌] 김근희 기자 = 국내 제약 업계가 정부의 '글로벌 혁신신약 약가우대제도 개정안'에 거세게 반발하고 있다. 국내 제약사들을 육성하겠다는 본래 취지에 어긋나게, 비현실적으로 기준이 변했다는 지적이 나온다. 한국제약바이오협회 등은 개정안 전면 수정을 요구하고 나섰다.
◆ 한미FTA 재협상서 개정 합의
12일 관련 업계에 따르면 한국제약바이오협회는 최근 성명서를 내고, 혁신신약 약가우대제도 개정안 전면 수정을 촉구했다.
글로벌 혁신신약 약가제도는 국내 임상시험, 연구·개발(R&D) 투자 등 보건의료 향상에 기여한 약제의 약가를 우대하고 등재 기간을 단축하는 제도다. 그동안 미국 측은 이 제도가 국내 제약사에만 유리하다며 수정을 요구했다. 결국 한미 자유무역협정(FTA) 재협상을 통해 관련 제도를 개정하기로 했다.
정부는 지난 7일 글로벌 혁신신약 약가우대제도 개정 내용을 담은 '약제의 요양급여대상 여부 등의 평가 기준 및 절차 등에 관한 규정' 일부개정규정(안)을 40일간 행정 예고했다.
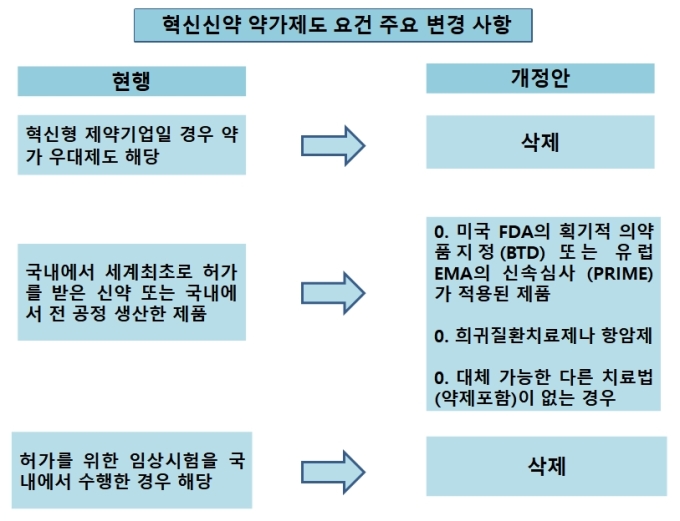
이번 정부 개정안에 따르면 약가 우대를 위해서는 기업요건과 제품요건 모두 만족시켜야 한다. 기업요건은 필수의약품 수입·생산이다. 단, 공급의무를 위반하거나 리베이트 제공이 적발된 제약사는 제외된다.
제품요건은 △새로운 기전 또는 물질 △대체 가능한 다른 치료법(약제 포함) 없음 △생존 기간의 상당한 연장 등 임상적 유용성 개선 입증 △미국 FDA의 획기적 의약품지정(BTD) 또는 유럽 EMA의 신속심사 (PRIME) 적용 △희귀질환 치료제 또는 항암제 등이다.
◆ 개정안 나오자 국내 제약사 '불만'
개정안이 공개되자 국내 제약업계가 들끓었다. 업체들은 개정안이 본래 제도 취지와 어긋나게 국내 제약사에 불리하다고 주장한다.
애초에 혁신신약 약가제도는 국내 제약사들을 육성하기 위해 만든 제도다. 한국의 경우 약가 책정이 보수적이라, 국내 제약사들이 신약을 만들고도 손해를 보는 경우가 많았다. 수출 계약 시 한국의 약가를 기준으로 가격이 책정되기 때문에, 신약 가치를 인정받는 데 한계가 있었다. 실제로 보령제약의 신약 '카나브'의 경우 이러한 문제 때문에 터키 수출이 무산된 바 있다.
약가 책정 제도에 대한 국내사의 불만이 끊이질 않자, 정부는 2016년 약가 10%를 더 쳐주는 '혁신신약 약가우대제도'를 내놨다. 정부는 국내 제약사에 우선적으로 혜택을 주기 위해 충족 조건으로 혁신형 제약기업 선정, 국내 임상시험 수행 등을 포함했다.
그러나 이번 개정안에는 국내 임상 수행 관련 등의 조건이 빠졌다. 대신 '미국 FDA의 획기적의약품지정(BTD) 또는 유럽 EMA의 신속심사 (PRIME) 적용' 조항이 신설됐다. 국내 제약사들이 혁신신약 약가우대를 받기 위해서는 해외 허가당국의 지정을 받아야 하는 것이다.
제약협회 관계자는 "연구개발, 국내 임상 수행 등의 관련 조항이 전면 삭제되면서 당초 취지가 무색해졌다"며 "미국 FDA나 유럽 EMA의 신속심사 승인 등 외국의 허가를 전제조건으로 삼는 것은 말이 안 된다"고 지적했다.
한 제약사 관계자도 "국내 제약사 중 개정안의 조건을 충족할 수 있는 제약사들은 거의 없을 것"이라며 "국내 제약산업을 육성한다고 하면서 정작 관련 정책들은 유명무실해지고 있다"고 토로했다.
◆ 다국적사들도 '답답'… "제도 사문화"
다국적 제약사도 이번 개정안에 대해 불만이 크다.
한국에 진출한 다국적제약사들이 회원인 한국글로벌의약산업협회(KRPIA) 역시 이번 개정안이 비현실적이라고 비판한다.
KRPIA 관계자는 "충족 요건을 희귀질환치료제나 항암제로 한정하고 제한했는데 사실상 이러한 조건을 만족시키는 신약은 거의 없을 것"이라며 "사문화된 우대제도가 될 수 있다"고 말했다.
국내 제약사들은 앞으로 관련 조치에 나설 예정이다. 이번 개정안이 행정예고된 만큼 의견이 있는 단체 또는 개인은 오는 12월17일까지 심사평가원 약제관리실(약제등재부)로 의견을 제출할 수 있다.
제약사들은 협회를 통하거나, 개별적으로 정부에 의견을 전달할 계획이다. 개개의 기업이 의견을 전달하기 부담스러운 만큼 협회를 통해 의견이 전달될 가능성이 높다.
협회 관계자는 "최근 성명서를 냈지만, 그외에 다양한 방식으로 의견을 정부에 전달할 것"이라며 "국내 제약 주권 지키기 위해 노력하겠다"고 강조했다.
keun@newspim.com
 영상
영상