[서울=뉴스핌] 김근희 기자 = 바이오 벤처기업 메드팩토가 이달 자체 개발 중인 신약 '백토서팁'과 다국적 제약사 MSD의 항암제를 함께 투여하는 임상시험을 시작했다. 올해 국내에서만 6개 임상시험의 승인을 받으면서 신약 개발에 박차를 가하고 있다.
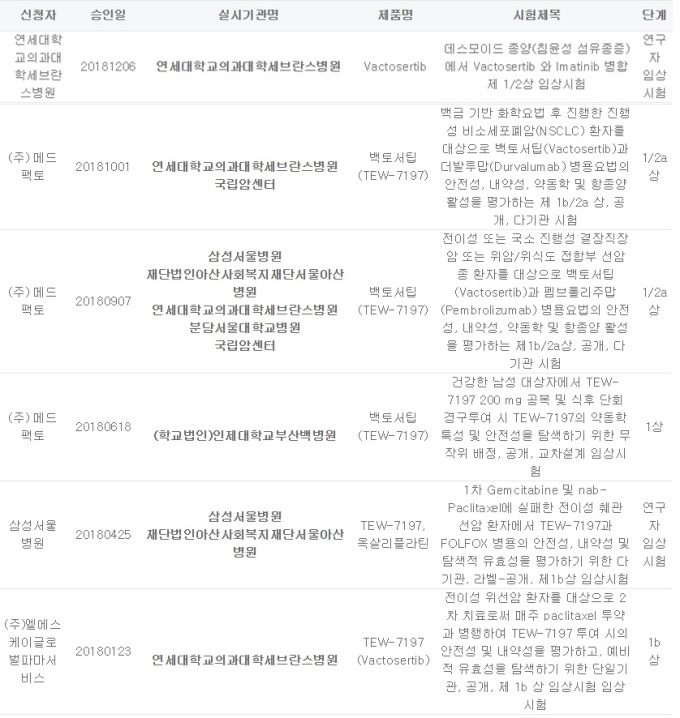
27일 식품의약품안전처와 관련 업계에 따르면 메드팩토는 지난 20일 백토서팁을 MSD의 면역항암제 키트루다와 병용투여하는 임상 1b·2a상의 첫 환자 투여를 시작했다. 앞으로 회사는 2년간 서울아산병원, 삼성서울병원, 분당서울대병원, 세브란스병원 등 5개 의료기관에서 약 60명의 환자를 대상으로 임상을 진행한다.
백토서팁은 메드팩토가 현재 개발 중인 신약 후보 물질로, 면역항암제의 치료 효과를 떨어트리는 'TGF-베타(TGF-β)'의 신호전달을 선택적으로 억제하는 물질이다. TGF-베타는 정상 세포에서는 암을 억제하지만, 암세포에서는 오히려 암 전이를 촉진한다. 또 암세포가 면역세포의 공격을 피하려고 주변에 섬유질을 쌓는데, 이 때도 TGF-베타가 분비된다.
면역항암제는 환자의 면역기능을 강화해 암을 치료하지만 그동안 TGF-베타 분비를 억제하지 못하기 때문에 치료 효과가 낮았다. 메드팩토는 백토서팁이 TGF-베타를 저해하는 등 암 주변 환경을 조절해, 면역항암제의 치료 효과를 높일 것이라고 보고 있다.
회사는 또 내년 또 다른 다국적 제약사 아스트라제네카의 면역항암제 '더발루맙'과 백토서팁의 1b·2a 병용임상을 시작할 계획이다.
메드팩토 관계자는 "키트루다와 더발루맙 병용임상은 각각 지난 9월과 10월에 임상승인을 받았다"며 "비교적 빠른 속도로 임상이 진행되고 있다"고 말했다.
메드팩토는 올해 총 6개의 임상시험을 식약처로부터 승인 받는 등 백토서팁 개발에 속도를 내고 있다.
회사는 지난 1월 위선암 환자를 대상으로 백토서팁과 항암제 '파클리탁셀' 병용 투여 임상 1b상을 시작으로 △ 1차 치료에 실패한 전이성 췌관 선암 환자를 대상 백토서팁과 항암제 '폴폭스'를 병용 투여하는 임상 1b상(연구자임상) △ 백토서팁의 음식물 영향 평가 △ 결장직장암 또는 위암·위식도 접합부 선암종 환자 대상 백토서팁과 키트루다 병용 임상 1b·2a상 △ 진행성 비소세포폐암(NSCLC) 환자 대상 백토서팁과 더발루맙 병용임상 제1b·2a상 등을 승인 받았다.
가장 최근인 지난 6일에는 데스모이드 종양(침윤성 섬유종증)에서 백토서팁과 다국적사 노바티스의 백혈병 치료제 '글리벡'(성분명 이마티닙)을 병합 투여하는 임상 1·2상 승인을 받았다. 연구자 임상시험으로 연세대학교의과대학세브란스병원에서 27~30명을 대상으로 임상을 진행한다.
이외에도 메드팩토는 미국에서 다발성골수종 환자 5명을 대상으로 기존 다발성골수종 치료제 '포말리도마이드'와 백토서팁을 병용 투여하는 연구자임상 1b상을 실시하고 있다.
회사는 지난 1일 미국 샌디에이고에서 열린 미국 혈액학회(ASH)에서 1b상 중간 결과를 발표하기도 했다. 중간 결과에 따르면 암이 더 이상 진행되지 않는 6개월 무(無)진행 생존률이 100%를 기록했다. 메드팩토는 이들 5명의 환자를 포함해 내년까지 총 27명을 대상으로 임상시험을 계속 진행할 계획이다.
keun@newspim.com
 영상
영상