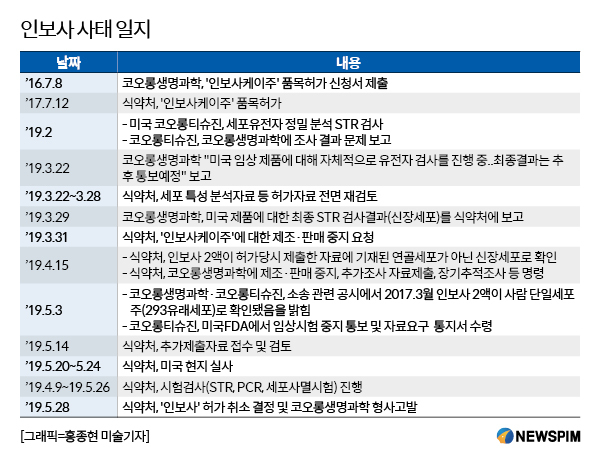
[서울=뉴스핌] 김양섭 기자 = 코오롱생명과학의 골관절염 세포유전자 치료제인 인보사케이주의 허가가 취소됐다. 식품의약품안전처는 인보사케이주 2액이 허가 당시 제출한 자료에 기재된 연골세포가 아닌 신장세포로 확인됐고 코오롱생명과학이 제출했던 자료가 허위로 밝혀짐에 따라 28일자로 인보사케이주에 대한 품목허가를 취소하고, 코오롱생명과학을 형사고발한다고 밝혔다.
코오롱생명과학의 자회사 코오롱티슈진이 개발해 2017년 7월 식약처로부터 29번째 국산 신약으로 시판 허가를 받았다. 약물 치료나 물리치료에도 효과를 보지 못하는 중증 무릎 골관절염 환자의 관절에 주사해 통증을 줄이는 역할을 한다. 1회 주사 시 통증 개선 효과가 1~2년간 지속된다.
인보사는 2017년 11월 제품 공식 출시 후 국내 의료기관 443곳에서 3403명에게 투여됐다. 임상 과정에서 투여 받은 환자는 145명이다. 1회 주사 비용은 600만~700만원 선이다.
미국에서 제품을 개발 중인 코오롱티슈진은 2015년 5월 FDA로부터 임상 3상 승인을 받고 현지 시판 허가를 받기 위해 지난해 11월부터 임상 환자를 대상으로 투약을 시작했다.
인보사 사태가 세상에 드러난 것은 지난 3월 말이다.
인보사는 사람의 연골세포(HC)와 연골세포 성장인자(TGF-β1)를 도입한 형질 전환 세포(TC)를 섞은 제품이다. 그런데 미국 검사법에 맞춰 제품을 조사하던 중 이 형질 전환 세포가 담긴 세포가 당초 허가 당시 제출한 자료에 기재된 세포와 다르다는 점을 발견하면서 문제가 불거졌다. 제품에 연골세포가 들어가야 하지만 실제로는 신장 유래 세포가 들어간 것이다.
식약처는 3월 31일 인보사의 주성분 중 1개 성분이 허가 당시 제출한 자료와 다른 세포인 것으로 추정돼 코오롱생명과학 측에 제조·판매 중단을 요청했다고 발표했다. 문제가 된 세포의 유해성 등이 확인되지 않아 코오롱생명과학이 자발적으로 유통·판매를 중단하도록 했다는 게 당시 식약처의 설명이었다.
인보사에 문제가 있다는 것을 인지한 코오롱 측은 3월 22일 식약처에 이 사실을 뒤늦게 알렸고 3월 29일 최종 결과를 보고했다.
4월 15일 식약처는 인보사 2액이 허가당시 제출한 자료에 기재된 연골세포가 아닌 신장세포로 확인했다고 발표했다. 이에 따라 식약처는 코오롱생명과학에 제조·판매 중지, 추가조사 자료제출, 장기추적조사 명령조치 등을 내렸다.
5월3일 코오롱측에서 낸 공시에서도 새로운 사실이 발견됐다. 코오롱생명과학·코오롱티슈진이 소송 관련 공시를 하면서 2017년 3월에 이미 인보사 2액이 사람 단일세포주(293유래세포)로 확인됐다는 사실을 인지하고 있다는 내용이 나와 논란이 됐다. 이에 대해 식약처는 조사 결과 자료에 "코오롱생명과학은 이러한 검사결과를 코오롱티슈진으로부터 e-메일(2017.7.13)로 받은 것으로 보아, 당시 이 사실을 알고 있었다고 판단된다"고 기재했다.
5월 14일 식약처는 추가제출자료 접수 및 검토를 하고 20일부터 24일까지 미국 현지 실사를 했다. STR, PCR, 세포사멸시험 등의 시험검사를 진행하고 식약처는 28일 '인보사' 품목허가 취소 결정을 내렸다. 또 코오롱생명과학에 대해서는 형사고발 조치를 할 계획이다.
ssup825@newspim.com
 영상
영상