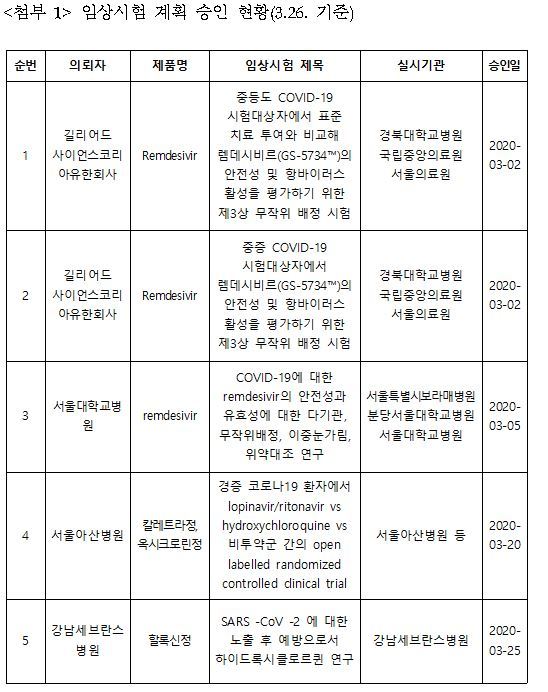
[서울=뉴스핌] 박다영 기자 = 신종 코로나바이러스 감염증(코로나19) 관련 임상시험이 현재까지 11건 신청됐다. 식품의약품안전처는 대한감염학회, 대한항균요법학회 등 전문가 자문을 거쳐 이 중 5건을 승인했다.
식약처는 코로나19 치료제·백신 개발 관련 사항을 27일 밝혔다.
다국적 제약사 길리어드의 에볼라치료제 렘데시비르 관련 임상시험은 3건, 인체면역결핍바이러스(HIV) 치료제 칼레트라와 말라리아치료제 히드록시클로로퀸정 관련 임상시험은 1건이 식약처로부터 임상시험계획 승인을 받았다. 히드록시클로로퀸 관련 임상시험도 1건 승인받았다.
식약처는 임상시험 외에 인플루엔자 치료제로 임상시험을 하고 있는 이뮨메드의 'HzVSF'과 관련해 6건을 코로나19 치료목적으로 사용 승인을했고 10건은 검토중이다.
치료목적 사용승인은 생명이 위급하거나 대체치료수단이 없는 응급환자 등의 치료를 위해 의약품으로 허가되기 전 임상시험용의약품을 식약처 승인을 받아 사용할 수 있도록 하는 제도다.
식약처는 백신·치료제 개발 지원을 위해 지난 2월 3일 코로나19 위기대응지원본부 내 제품화팀을 구성했다. 이를 통해 코로나19 치료제·백신 개발을 준비중인 제약사를 대상으로 별도 상담창구를 운영해 제품화를 지원하고 관련 임상시험을 우선·신속 심사하고 있다.
또한 코로나19 치료제 개발에 걸리는 시간을 단축하기 위해 과학기술정보통신부, 질병관리본부와 협력하고 있다.
과학기술정보통신부는 미국 식품의약국(FDA)에서 허가된 의약품 중 코로나19 치료에 효과적인 약물을 발굴해 연구결과를 의료계에 전달하고 임상에 활용할 수 있도록 지원하는 '약물재창출사업'을 수행하고 있다. 질병관리본부는 코로나19 치료제 개발을 위해 기존약물 사용범위를 확대하고, 항체치료제·혈장치료제·백신에 대해 임상시험 연구과제를 수행하고 있다.
국내 허가가 없는 의약품 중 코로나19 치료를 위해 질병관리본부가 요청하는 경우에는 특례수입을 하고 있다.
원칙적으로 의약품을 수입하기 위해서는 품목허가가 필요하다. 특례수입이란 감염병 대유행 등의 상황에서 관계부처장이 요청한 경우에 한해 품목허가 없이 의약품을 수입하는 제도다.
HIV 치료제 칼레트라는 3차례 특례수입 조치를 했다. 칼레트라정, 히드록시클로로퀸정 등 말라리아 치료제는 국내 공급 현황을 모니터링해 필요한 경우 수입 혹은 생산될 수 있도록 하고 있다.
26일 기준 칼레트라정은 현재 약 1만5000명분, 히드록시클로로퀸정은 약 20만명분을 업체에서 보유하고 있다.
식약처 관계자는 "코로나19 치료제·백신이 신속히 개발될 수 있도록 적극적으로 지원하고 관계 부처와 긴밀히 협력해 의약품이 충분히 공급될 수 있도록 관리하겠다"라고 말했다.
allzero@newspim.com
 영상
영상