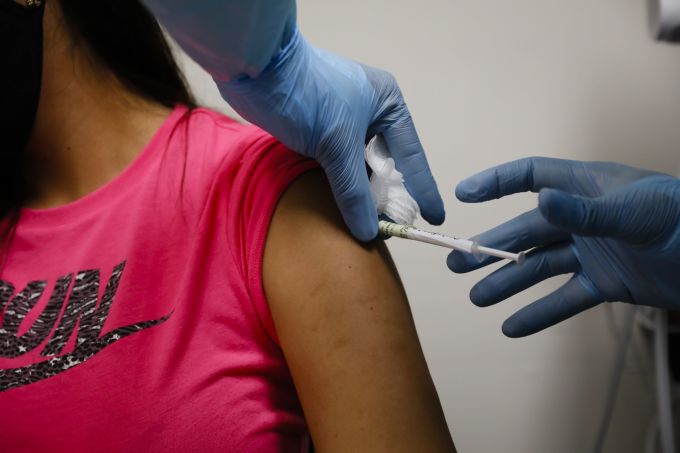
[서울=뉴스핌] 최원진 기자 = 미국 식품의약국(FDA)이 코로나19(COVID-19) 백신 긴급사용 승인과 관련해 제약사들에 더 많은 임상시험 데이터 자료를 제출하도록 하는 등 심사기준을 높일 방침인 것으로 알려졌다.
10일(현지시간) 블룸버그통신에 따르면 스티븐 한 FDA 국장은 이날 트위터를 통해 당국이 코로나19 백신 긴급사용승인(EUA)을 신청할 때 제출해야 할 서류들을 포함한 가이드라인을 배포할 계획이라고 알렸다.
지침은 FDA가 원하는 구체적인 임상시험 데이터들을 요구한다. 지난 6월 배포 지침에는 제약사들이 최소 50%의 백신 효능을 뒷받침하는 증거 자료들을 제출하도록 했다.
새롭게 바뀐 EUA 신청 지침은 더 방대한 증거 자료 제출 등 정규 사용승인 신청에 버금가는 수준으로 엄격해졌다는 전언이다.
피터 마크스 FDA 산하 생물의약품 평가연구 센터장은 EUA 신청 지침이 정기적인 사용승인 신청 표준에 가까울 것이며, 향후 백신이 시장에 출시되면 추가적인 안전성 모니터링이 있을 것이라고 알렸다.
이는 오는 11월 3일 선거일까지 백신 접종을 가능케 하길 원하는 도널드 트럼프 대통령에게 있어 좋지 않은 소식일 수 있다. 3차 임상시험 데이터 공개와 동시에 긴급사용 승인을 기대했던터라 보다 엄격한 심사기준은 출시 지연으로 이어질 수 있어서다.
한 FDA 국장은 이날 워싱턴 이코노믹클럽 행사에서 당국은 아직 어느 제약사로부터도 임상시험 데이터를 제출받은 적이 없다고 했다. 이에 "어떠한 추측을 하기 부적절하다. 우리는 임상데이터가 없다. 언제 우리가 받아볼지도 알 길이 없다"고 말했다.
wonjc6@newspim.com
 영상
영상