[뉴욕=뉴스핌]김근철 특파원=미국의 식품의약국(FDA)은 화이자의 코로나19(COVID-19) 백신이 긴급승인을 위한 기준에 부합하는 것으로 나타났다고 8일(현지시간) 밝혔다.
로이터통신과 월스트리트저널(WSJ) 등에 따르면 FDA는 이날 자체 과학자들이 작성한 분석보고서와 코로나19 백신을 독일 바이오엔테크와 공동 개발한 화이자가 제출한 데이터를 함께 공개하며 이같이 확인했다.
화이자는 임상 결과 자사의 백신이 2차 접종시 코로나19 예방에 95% 효능을 보였고 주요한 안전 문제가 나오지 않았다고 밝혔다. 화이자 백신은 1차 접종을 하고 3주 뒤에 2차 접종을 해야 한다.
FDA는 자체 분석보고서를 통해 화이자의 백신 2차 접종후 최소 7일 후에는 코로나19 감염 위험이 감소하는 효능이 있다고 확인했다. FDA는 또 1차 접종 이후에도 중증 코로나19 감염 위험이 감소하는 등 상당한 효과를 보였다고 밝혔다.
이 보고서에 참여한 FDA의 마이클 예 분석관은 이같은 데이터가 "매우 단순하고 명료하기 때문에 우리는 긴급 승인을 받을 수 있다고 생각한다"고 밝혔다.
FDA는 오는 10일 화이자 백신에 대한 전문가 회의를 개최, 이를 토대로 긴급 사용 허가 여부를 결정한다. 외신들은 이날 나온 검토 자료가 마지막 장애물을 제거했다면서 FDA의 화이자 코로나19 백신 긴급 사용 허가에 청신호가 켜진 셈이라고 평가했다.
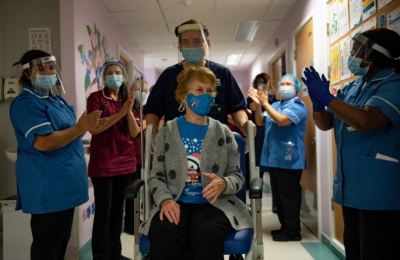
한편 미국에 앞서 화이자 백신 긴급 사용을 허가한 영국은 이날부터 80세 이상 노인들을 대상으로 접종을 시작했다.
kckim100@newspim.com
 영상
영상