[서울=뉴스핌] 김근희 기자 = 임상시험 3상을 나중에 하는 조건으로 우선 판매 허가를 받은 의약품 23개 중 절반 가까이는 생산실적이 전혀 없는 것으로 조사됐다.
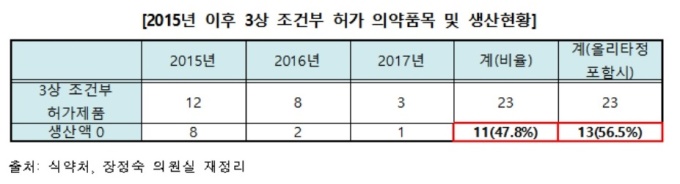
15일 국회 보건복지위원회 장정숙 의원(바른미래당)이 식품의약품안전처로부터 제출 받은 최근 3년간 '임상 3상 조건부 허가 신청 및 통계 현황'에 따르면 2015년 이후 조건부 허가를 신청한 의약품 23건 중 21건이 허가를 받았다. 허가 통과율이 91.3%인 셈이다.
임상 3상 조건부 허가는 암, 희귀질병 등 생명을 위협하는 질병이나, 치료법이 없는 환자들에게 신속한 치료기회를 제공하고자 만든 제도다. 이 제도에 해당되면 임상 2상만 마쳐도 품목허가를 받을 수 있다. 임상 3상은 제품 판매 후에 시행·제출하면 된다.
그러나 임상 3상 조건부 허가를 받은 의약품 23개 중 약 47.8%에 해당하는 11개가 현재 생산실적이 전혀 없는 것으로 드러났다. 지난 4월13일 한미약품이 올리타정 200mg와 400mg 개발 중단 계획서를 제출하면서, 사실상 절반이 넘는 13개의 의약품이 생산되지 않은 것이다.
판매 허가를 받은 이후 단 한번도 생산을 하지 않은 제품은 ▲코텔릭정20mg ▲트랜스라나과립 125mg, 250mg, 1000mg ▲로스미르 등 총 5개 의약품이다. 올해 기준으로 생산이 전혀 되지 않는 제품은 ▲리아백스주 ▲입랜스캡슐 75mg, 125mg ▲자이카디아캡슐 150mg 등 4개다.
생산이 전혀 없었고 품목을 자진 취소한 제품은 ▲자이델릭정 100mg, 150mg 등이다. 한미약품도 올리타정 200mg과 400mg도의 개발 중단 계획서를 제출했다.
또 조건부 허가 제도가 국산신약 개발을 돕기 위해 만든 제도임에도 불구하고, 국산신약이 적다는 지적이다. 23개 품목 중 국산 신약은 단 3개뿐이었다.
장 의원은 "환자 치료 때문에 허가를 빨리 내줬는데도 환자들에게 치료제를 공급하지 않는다면 '조건부 허가제'의 의미는 퇴색된다"며 "식약처는 허가 전 수요조사, 시판 후 공급계획, 사후 조건충족 여부 등 전반에 대해 사전조사를 하고, 생산이 없는 제품은 과감히 정비해야 해야 한다"고 말했다.
keun@newspim.com
 영상
영상